Локорегионарное лучевое воздействие, традиционно используемое на предоперационном этапе в лечении местнораспространенного рака молочной железы, не всегда является адекватным. Представление о раке молочной железы как о системном заболевании, при котором уже на ранних этапах имеются отдаленные микрометастазы, явилось основанием для проведения системной химиотерапии [1,3]. Учитывая системный характер заболевания, более целесообразным, особенно при наличии факторов, маркирующих возможное отдаленное метастазирование (врастание в кожу, метастатическое поражение лимфоузлов и др.), является применение химиотерапии.
На сегодняшний день наиболее используемыми схемами для лечения местнораспространенного рака молочной железы являются схемы с применением антрациклинов. Чаще всего используется схема CAF.
Известно, что увеличение кумулятивной дозы химиопрепаратов, в первую очередь антрациклинов, приводит к увеличению частоты и выраженности сердечных нарушений [2].
Причинами своеобразного отставания представлений об истинной частоте, патогенезе, клиническом течении и других характеристиках кардиотоксичности химиопрепаратов по сравнению с более очевидными осложнениями химиотерапии (тошнотой, рвотой, мукозитами, цитопениями и др.) явились определенные специфические особенности и трудности в распознавании в ранние сроки с ориентацией, прежде всего, лишь на изменения на ЭКГ. К таким особенностям, прежде всего, относят:
Зависимость кардиотоксичности от кумулятивной дозы химиопрепаратов.
Возникновение, кроме острой и отстроченной, крайне трудно обратимой хронической кардиомиопатии с тяжелой застойной сердечной недостаточностью, развивающейся спустя месяцы и годы после окончания химиотерапии у 0,5-6,2% больных со смертностью от 42,9 до 100%.
Вероятность внезапного появления сердечной недостаточности без каких-либо предшествующих признаков (в том числе и по ЭКГ) еще до получения больным эмпирически установленной «критической» общей дозы препарата. Известно, что при использовании доксорубицина риск развития симптомов сердечной недостаточности составляет 7, 15, и 30% при суммарных дозах 550, 600 и 700 мг/м соответственно, и лишь при суммарной дозе менее 450 мг/м2 риск повреждения миокарда минимален при условии отсутствия сопутствующей сердечной патологии (рис. 1). Таким образом, совершенно ясно, что при отсутствии профилактических мер подобная кардиотоксичность существенно ограничивает возможности химиотерапии.
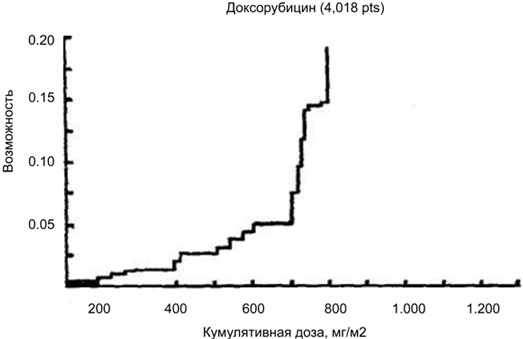
Рис. 1. Кардиотоксичность доксорубицина.
На сегодняшний день наиболее успешно для профилактики кардиотоксичности химиопрепаратов является преперат кардиоксан (2). В то же время, использование кардиоксана ограничено его стоимостью. В этой связи нами было предложено применять антиоксидантный препарат янтарной кислоты реамберин (НПФ «Полисан» г. Санкт-Петербург).
Цель исследования:
Улучшение результатов лечения больных местнораспространенным раком молочной железы на основе оптимизации химиотерапевтических схем.
Профилактика кардиотоксических эффектов химиопрепаратов с помощью препарата реамберин.
Материалы и методы. С декабря 2002 года в исследование включены 103 больных с гистологически верифицированным местнораспространенным раком молочной железы (T3-4N1-3M0) в возрасте 18-55 лет, давшие письменное информированное согласие на участие в данном исследовании. Перед началом лечения проводилось комплексное обследование молочных желез, включающих клиническое обследование, УЗИ или маммографию, в зависимости от возраста. Пациентам до начала лечения выполнялась трепанбиопсия с последующим изучением фактора прогноза HER2/neu и рецепторов к эстрогенам и прогестерону.
Для выявления изначальной сердечной патологии больные проходили ЭКГ, ЭХоКГ, холтеровское мониторирование.
В исследуемой нами группе пациентов до начала химиотерапии достоверно значимой патологии со стороны сердечно-сосудистой системы, исходя из жалоб больных, данных анамнеза, осмотра, ЭКГ, ЭХоКГ, холтеровского мониторирования выявлено не было.
В проводимом нами исследовании пациенты были разделены на 2 группы:
1-я группа больных с гистологически верифицированным местнораспространенным раком молочной железы (51 человек) получали 4 курса полихимиотерапии (ПХТ) по схеме CAF (циклофосфан 100 мг/м2, 1-14 день в/м, адриамицин 30 мг/м в 1 и 8 день в/в, фторурацил 500 мг/м2 1 и 8 день в/в);
2-я группа больных (52 человека) с целью интенсификации проводимой терапии получала чередование схемы CAF и схемы AVCFM (адриамицин 30 мг/м в 1 день в/в, винкристин 1 мг/м2 в 1 день в/в, циклофосфан 300 мг/м2 2-5 день в/в, фторурацил 400 мг/м2 2-5 день в/в, метотрексат 20 мг/м2 2-3 день в/в); всего 4 курса.
После каждого курса оценивался размер опухоли пальпаторно, по данным УЗИ, маммографии.
Ежедневно осуществлялся забор крови на общий анализ.
Для уменьшения кардиотоксических эффектов антрациклинов был использован антиоксидантный препарат янтарной кислоты реамберин. С целью изучения применения реамберина совместно с химиотерапией пациенты были разделены в каждой группе на 2 подгруппы, одна из которых получала только ПХТ, а другая –ПХТ вместе с реамберином в/в капельно 400 мг № 5.
B l-й группе больные, получающие ПХТ по схеме CAF без реамберина (25 человек), уже после первого курса ПХТ 7 пациентов (28,0%) отмечали учащенное сердцебиение, эпизоды подъема АД, боли за грудиной и др. По данным ЭКГ после 3-го курса ПХТ по схеме CAF у 3 пациентов (12,0%) были выявлены признаки перегрузки левого желудочка. По данным ЭХоКГ после 4 курса у 5 пациентов (20,0%) определялось снижение фракции выброса левого желудочка. По данным холтеровского мониторирования у 11 пациентов (44,0%) после 4 курса ПХТ была выявлена суправентрикулярная экстрасистолия, у 10 пациентов (40,0%) – метаболические изменения в конечной части желудочкового комплекса в виде снижения вольтажа и инверсии зубца Т (рис. 1).
Во 2-й группе пациентов (26 человек), получающих интермиттирующие введения, без реамберина 10 пациентов (38,5% ) после 1-го курса ПХТ отмечали боли в сердце после умеренных физических нагрузок. Перегрузка левого желудочка после 3 курса ПХТ выявлена у 5 пациентов (19,0%). После 4 курса ПХТ у 6 пациентов (23%) по данным ЭХоКГ выявлено снижение фракции левого желудочка. По данным холтеровского мониторирования у 15 пациентов (57,6%) определялись суправентрикулярные экстрасистолы, у 7 пациентов (27,0%) – метаболические изменения в конечной части желудочкового комплекса в виде снижения вольтажа и инверсии зубца Т (рис. 2).
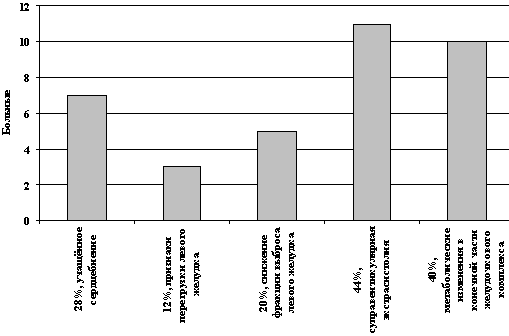
Рис. 1. Сердечные нарушения у
больных 1-ой группы
(без реамберина)
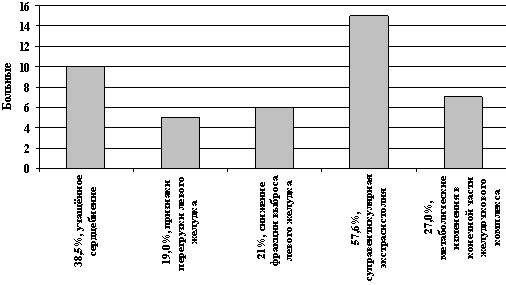
Рис. 2. Сердечные нарушения у больных 2-ой
группы
(без реамберина)
Пациенты обеих групп, получающие ПХТ с реамберином, не имели кардиальных жалоб. По ЭКГ признаков перегрузки левого желудочка не было. На ЭХоКГ зарегистрировано снижение фракции выброса левого желудочка у 3-х пациентов 1-ой группы (11,5%) и у 4 пациентов 2-ой группы (15,3%). Суправентрикулярная экстрасистолия по данным холтеровского мониторирования у больных 1-ой группы отмечена у 7 человек (27%), у больных 2-ой группы -10 человек (38,5%). Снижение вольтажа желудочкового комплекса в 1-ой группе зарегистрировано у 3 (11,5%), у больных 2-ой группы – у 6 (23% ) больных (рис. 3).
У 30 больных (58,8%) 1-ой группы после 4 курсов по схеме САГ стало возможным выполнение хирургического этапа лечения. Две пациентки отказались от хирургического лечения. У 17 больных в этой группе была выполнена радикальная мастэктомия по Пейти, у 11 больных – радикальная резекция с пластикой торакодорзальным лоскутом или фрагментом широчайшей мышцы спины. Полный морфологический эффект зарегистрирован у 5 больных (18,0%), умеренный морфологический эффект – у 15 больных (53,5%), слабый – у 8 больных (28,5%).
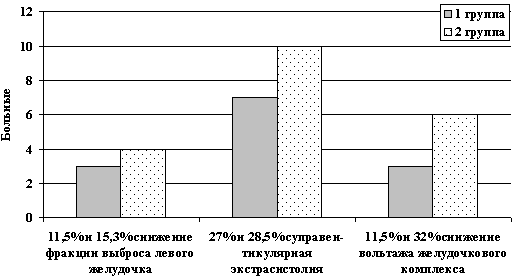
Рис. 3. Сравнительная оценка сердечных
нарушений
у больных 1-ой и 2-ой групп
(с реамберином)
Таблица 1. Токсичность комбинаций
интермиттирующего введения и схемы CAF
|
Виды токсичности |
Больные с данным осложнением, % |
|
|
Интермиттирующие |
CAF |
|
|
Острая токсичность |
||
|
Нейтропения 3-4 степени |
67 |
34 |
|
Фебрильная нейтропения |
0 |
0 |
|
Тромбоцитопения 3-4 степени |
3 |
2 |
|
Тошнота 2 степени и более |
45 |
49 |
|
Рвота 2 степени и более |
38 |
27 |
|
Диарея 2 степени и более |
0 |
1 |
|
Стоматит 2 степени и более |
24 |
19 |
|
Аллопеция 2 степени и более |
68 |
83 |
|
Отсроченная токсичность |
||
|
Сердечная недостаточность |
0,4 |
1.7 |
|
Острая лейкемия |
0 |
0 |
21 больная с отечными формами рака молочной железы в дальнейшем получали лучевую терапия (СОД 58-60 Гр). После лучевой терапии 2 больным стало возможным выполнение радикальной мастэктомии по Пейти. 19 пациентам в связи с сохраняющимся отеком молочной железы в дальнейшем были проведены еще 4 курса ПХТ по схеме CAF, затем при наличии положительных рецепторов к эстрогенам и (или) прогестерону им назначался.тамоксифен (20 мг/сутки).
У больных 2-ой группы после 4 курсов с чередованием схем CAF и AVCFM ПХТ у 37 больных (71,1%) стало возможным выполнение хирургического этапа лечения (у 24 больных – радикальная мастэктомия, у 13 – радикальная резекция с пластикой торакодорзальным лоскутом или фрагментом широчайшей мышцы спины).
Полный морфологический эффект наблюдался у 13 больных (35%), умеренный – у 18 больных (48,6%), слабый – у 6 (16,4%).
15-ти больным в связи с сохраняющимся отеком молочной железы проведена лучевая терапия (СОД 58-60 Гр). После лучевой терапии мастэктомия выполнена у 8 больных, 6 больных в дальнейшем получили еще 4 курса ПХТ, затем – гормонотерапию.
Режим интермиттирующего введения в целом оказался токсичнее стандартного CAF по воказателям как гематологической, так и негематологической токсичности (табл. 1).
Больные обеих групп наиболее часто испытывали осложнения со стороны желудочно-кишечного тракта, проявлявшиеся в виде тошноты и/или/ рвоты, стоматита, реже – диареи. Однако следует пояснить, что данное исследование проводилось без широкого использования высокоэффективных антиэметиков из группы антагонистов серотонина (5-НТЗ).
Несмотря на большую токсичность интермиттирующего введения, все больные этой группы, так же как и группы CAF полностью завершили запланированный объем лечения.
На сегодняшний день живы все больные обеих групп. Исследование продолжается.
Выводы:
- Предложенная комбинация CAF и AVCFM для неоадъювантного режима полихимиотерапии показала свою высокую эффективность, умеренную токсичность и может быть использована для лечения больных местнораспространенным раком молочной железы.
- Использование препарата реамберин позволило в значительной степени снизить кардиотоксическое действие антрациклинов при полихимиотерапии у больных местнораспространенным раком молочной железы.
Список литературы
- Тюляндин С.А. Системная терапия рака молочной железы / С.А. Тюляндин // Практическая онкология - 2002. Т. 3, № 1, - С. 29-31.
- Гершанович М.Л. Кардиоксан как протектор кардиотоксичности антрациклинов / М.Л. Гершанович // Вопросы онкологии - 2003, т. 42.- С. 98-99.
- Стенина М.Б. Фармарубицин в адъювантной терапии рака молочной железы. / М.Б. Стенина // Современная онкология 2004.- Т. 6, № 1, С. 18-24.
Summary
The purpose of optimization of approach to the neoadquvant chemotherapy with locally spread of breast cancer randomased with the method of a pocked their were used the alternate introductions of chemical preparations according to the schemes CAF and AVCFM. The preparations Reamberin has been used as cardioprotector.
With the patients after four courses with alternate schemes CAF and AVCFM (80 patients) with 63 patients (78,8%) the execution of surgery stage of treatment has be came possible.
In the group of patients treated with chemotherapy with Reamberin their were no cardio complains end signs of overloading the left ventricular.