Опубликовано в журнале:
«Український біохімічний журнал»,
2005, Т. 77, №4 с. 25-45
ФГУП “Государственный научно-исследовательский институт витаминов”, Москва
В.М. Копелевич
В огляді наведено результати досліджень останніх років, які стали науковою основою для розуміння молекулярних аспектів застосування карнітину в медицині.
Карнітин – сполука, що є необхідною для транспортувальних ацильних похідних кофермента А крізь внутрішню мітохондріальну мембрану для їхнього І-окислення в матриці мітохондрії. Біологічно активним є тільки L-ізомер карнітину, у той самий час D-ізомер конкурентно гальмує активність системи захоплення та перенесення L-карнітину і перешкоджає окисленню жирних кислот у мітохондрії. За взаємодії з системою СоА карнітин включається у проміжний обмін речовин шляхом модуляції пула вільного СоА у клітині. Наведено детоксикувальні властивості L-карнітину, його участь в анаболічних процесах, апоптозі, а також його нейрозахисну дію.
Недостатність карнітину спричинює різноманітні прояви і поділяється на первинну та вторинну.
Первинну недостатність генетично обумовлено порушенням транспортування карнітину у клітини та тканини, а вторинна є наслідком великої групи спадкових та набутих захворювань.
Обговорено патофізіологічні стани, що є наслідком дефіциту карнітину. Показано ефективність використання L-карнітину для корекції первинної та вторинної його недостатності. Ацетил-L-карнітин поліпшує когнітивні функції мозку, значною мірою уповільнює процеси старіння, що зумовлені порушеннями в мітохондріях, поліпшує якість життя в похилому віці. Обговорюються терапевтичні можливості L-карнітину та ацетил-L-карнітину.
СОДЕРЖАНИЕ
Введение
1. БИОСИНТЕЗ L-КАРНИТИНА И ЕГО БИОХИМИЧЕСКИЕ ФУНКЦИИ
2. ИЗОМЕРЫ КАРНИТИНА
3. ПОТРЕБНОСТЬ ЧЕЛОВЕКА В L-КАРНИТИНЕ И ЕГО НЕДОСТАТОЧНОСТЬ
4. КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ КАРНИТИНА
5. КАРНИТИНОВАЯ СИСТЕМА И ОПТИМИЗАЦИЯ ВНУТРИКЛЕТОЧНОГО МЕТАБОЛИЗМА
ПРИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЯХ
6. АЦЕТИЛКАРНИТИН В КАЧЕСТВЕ ФАРМАКОЛОГИЧЕСКОГО АГЕНТА
6.1. АЛК и обратимость нарушений, вызванных старением
6.2. Защита мозга и нейродегенеративные заболевания
6.3. Депрессивные расстройства в позднем возрасте
6.4. Регенерация нервных клеток
6.5. Нейропатические боли
6.6. Профилактика катаракты
7. ПРЕПАРАТЫ L-КАРНИТИНА И АЛК
Список литературы
Современная наука о витаминах и витаминоподобных веществах — витаминология достигла в последние годы значительных успехов в расшифровке механизма их действия, что послужило основой более грамотного применения таких препаратов. Витамины так широко вошли в нашу жизнь, что сейчас невозможно переоценить тот импульс в истории человеческого познания, который сделал открытие витаминов в первой половине 20 века, установление их роли в жизни человека, перевернувшее наши представления об окружающем мире. Развитие витаминологии началось в 30-40 годы 20 века на стыке химии, биохимии, медицины и физиологии. Следует отметить, что большой вклад в это внесли ученые бывшего СССР, в частности академики А.В. Палладии и Р.В. Чаговец, 100-летний юбилей которого широко отмечался в 2004 году. Своими исследованиями академик Р.В. Чаговец и его сотрудники доказали, что витамины действительно способны излечивать от многих заболеваний, отдалять старость, побеждать немощь и продлевать жизнь. Они обосновали положение о дозазависимом эффекте витаминов и витаминоподобных веществ, что в настоящее время имеет большое практическое значение для клинического применения этой группы соединений, включая L-карнитин и его производные.

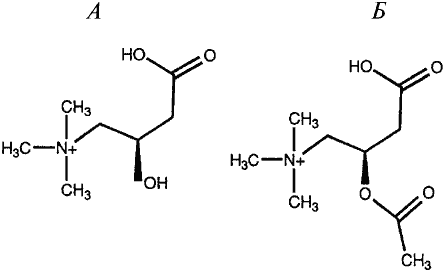
Химическая структура L-карнитина (А) и ацетил-L-карнитина (Б)
L-Карнитин (l-3-гидрокси-4-N-(триметил-аммоний) масляная кислота), который по химическому строению можно рассматривать как производное і-аминомасляной кислоты, присутствует в биологических системах как в свободном виде, так и в форме О-ацильных эфиров, включая ацетил-L-карнитин (АЛК) (рисунок). L-Карнитин впервые выделили в 1905 году В.С. Гулевич и Р. Кримберг из экстракта тканей мышц (отсюда и название: carnis по-латыни – мясо). В 1927 году с помощью химического синтеза была установлена его структура. С момента открытия L-карнитина прошло ровно 100 лет и за это время накоплен огромный фактический материал о его распространении в природе, биологических функциях, а также применении в медицине.
В 1952 г. А. Френкель опытным путем установил, что L-карнитин является незаменимым фактором роста для мучного червя Tenebrio molitor, в связи с чем его назвали витамином Вт. Позднее было установлено, что L-карнитин синтезируется также в организме человека и высших животных. И. Фритц в 1958 г. определил, что L-карнитин повышает скорость окисления жиров в митохондриях. Эта работа заложила основы изучения фундаментальной его роли в окислении жиров. В 1960—1970 годы появилось значительное число работ по изучению функциональной роли L-карнитина. В эти же годы разработаны химические методы синтеза рацемического карнитина. В 1980 годы L-карнитин становится коммерчески доступным. С этого года и до настоящего времени отмечается заметное повышение числа научных публикаций по изучению роли L-карнитина в обмене веществ. Эти исследования раскрывают возможности его применения для поддержания нормального функционирования организма человека, лечения различных заболеваний и улучшения качества жизни. К 2004 году имелось уже более 10 000 научных сообщений и ежегодно публикуется около 300 работ по изучению L-карнитина. В течение последних 30 лет лекарственные препараты и биологически активные добавки на основе L-карнитина и АЛК получили признание и появились на прилавках аптек и специализированных магазинов. Из приведенной краткой исторической хроники видно, какой значительный период времени прошел от открытия L-карнитина до его практического использования в качестве лечебного средства и доступной пищевой добавки [1,2]. Многие эксперты определяют сейчас витамины как низкомолекулярные органические компоненты пищи, абсолютно необходимые для поддержания жизненных функций, которые не образуются или образуются в недостаточном количестве в организме и поступают в него с пищей. Они регулируют самостоятельно или в составе ферментов обмен веществ и оказывают разностороннее влияние на жизнедеятельность организма. В эту группу нутриентов, наряду с витаминами, некоторыми каротиноидами, биофлавоноидами, а также различными их метаболитами в организме человека, такими как кофермент Q10, α-липоевая кислота, холин, инозит, оротовая кислота, включен и L-карнитин. Важно также отметить функциональную взаимосвязь между L-карнитином и коферментом А на уровне регуляции внутриклеточного метаболизма. Более того, вполне вероятно, что терапевтический эффект L-карнитина и его эфиров обусловлен интегральным влиянием карнитиновой системы на содержание свободного СоА. Все это дает нам основание относиться к L-карнитину как "забытому" витамину группы В, хотя в настоящее время в большинстве научных публикаций, различных монографиях и документах L-карнитин определяется как витаминоподобное соединение. В настоящей статье рассматривается лишь незначительная часть той обширной литературы, которая опубликована, в основном, в последние 5-10 лет, о роли L-карнитина в метаболических процессах, а также о клиническом применении L-карнитина и его ацетильного производного.
В организме человека и животных L-карнитин синтезируется в печени и почках, из которых транспортируется в другие ткани и органы. Для того, чтобы происходил его синтез необходимы следующие исходные продукты: две незаменимые аминокислоты лизин и метионин, витамин С, витамин В3 (ниацин), В6, В12, фолиевая кислота и железо. При дефиците хотя бы одного из этих веществ собственный синтез L-карнитина заметно снижается. При этом установлено, что недостаток витамина С является определяющим и приводит к симптомам недостаточности L-карнитина, поскольку его биосинтез в этом случае практически не происходит. Для синтеза L-карнитина требуется 5 ферментов.
Промежуточный продукт синтеза N-триметиллизин превращается в гидрокситриметиллизин, который в цепи реакций, протекающих как в митохондриях, так и в цитозоле клетки, далее образует γ-бутиробетаин. Необходимые для этих этапов биосинтеза ферменты обнаружены в скелетных мышцах, сердце, печени, почках и мозгу. Превращение γ-бутиробетаина в L-карнитин происходит в реакции гидроксилирования под действием специфического фермента гидроксилазы, который обнаружен исключительно в печени, почках и мозгу, но его нет в скелетных или сердечных мышцах [3].
В организме млекопитающих L-карнитин не катаболизируется и выводится с мочой в неизменном виде или в форме О-ацильных производных [2, 4]. В митохондриях печени образуется ряд производных L-карнитина как с эндогенными веществами, так и с ксенобиотиками [5]. Он находится во всех тканях и органах и у взрослого человека его содержание составляет 20-25 г, из которых 97% находится в скелетных мышцах и миокарде, т.е. в тканях, использующих жирные кислоты как главный источник энергии. Это связано с тем, что L-карнитин играет важнейшую роль в переносе активированных жирных кислот через внешнюю мембрану митохондрий для процесса β-окисления.
Большие успехи в изучении роли L-карнитина в метаболических процессах, происходящих в организме, способствовали усовершенствованию способов его применения в практической медицине. На первом этапе применение L-карнитина было основано на простом принципе заместительной терапии: если при некотором заболевании происходит уменьшение содержания какого-либо метаболита, то последний может быть введен извне и таким образом он окажет лечебное действие. Благодаря научному прогрессу последних десятилетий большое число заболеваний и метаболических состояний, таких как, например, старение, стало возможным описать биохимическими терминами. Следовательно, созданы возможности для направленного изыскания лекарственных веществ, нормализующих метаболические процессы, что является основой современного подхода к вопросам метаболической терапии (регуляции нарушенных обменных процессов). Однако для успешного применения этого принципа необходимо понима ние того, какие звенья метаболизма нарушаются при конкретной патологии, а также какова роль отдельного метаболита в биохимических реакциях, протекающих в клетках и определяющих физиологические функции клетки, ткани, органа.
Что касается L-карнитина, то он, являясь объектом более чем 30-летнего широкого научного изучения, может служить в качестве примера исследований, которые должны быть проведены для рационального создания и применения метаболического лекарственного средства. Итак, остановимся более подробно на биохимических функциях L-карнитина в метаболизме живого организма.
1. Транспорт длинноцепочечных жирных кислот в митохондриальный матрикс. L-Карнитин играет роль "челнока" в процессе образования ацетил-СоА из жирных кислот. Поскольку процесс активации жирных кислот и их окисление пространственно разделены, в клетке функционирует механизм переноса длинноцепочечных жирных кислот через внутреннюю митохондриальную мембрану в митохондриальный матрикс с участием карнитина и специальной ферментной системы. Эта система обратимо перебрасывает ацил на внешней стороне мембраны с СоА на карнитин, а на внутренней – с карнитина на внутримитохондриальный СоА Жирные кислоты сначала с затратой энергии превращаются в длинноцепочечный ацил-СоА (ДЦАСоА), который не способен проходить через внутреннюю мембрану митохондрий, в то время как такой способностью обладает ацилкарнитин (ДЦАКар), образующийся в результате реакции карнитина с ДЦА-СоА. Образование ДЦАКар на митохондриальной мембране катализируется карнитинацилтрансферазами и карнитин является субстратом для этих ферментов. Этот процесс является обратимым и катализируется несколькими ферментами, которые классифицируются по их сродству к ацил-СоА [2]. Карнитинацетилтрансфераза (КАТ, 2.3.1.7) катализирует реакции короткоцепочечных ацилов с длиной цепи от 2 до 10 углеродных единиц. Для трансферазы длинноцепочечных ацилов (>10 атомов углерода) используют название карнитиноктаноилтрансфераза в случае вне-митохондриальных белков или карнитинпальмитоилтрансфераза (КПТ I) для митохондриальных ферментов. Последние две подгруппы ферментов проявляют широкую специфичность по отношению к среднецепочечным и длинноцепочечным ацил-СоА, обладая наибольшим сродством для деканоил-КоА [6].
Ацилкарнитины переносятся через внутреннюю митохондриальную мембрану с помощью транспортного белка, называемого карнитинацил-транслоказа. В митохондриальном матриксе ацилкарнитин взаимодействует с СоА при участии КПТ II, в результате чего вновь образуется ацил-СоА, который в процессе β-окисления превращается в ацетил-СоА, участвующий в цикле трикарбоновых кислот (ЦТК), и свободный карнитин. Высокая утилизация субстратов в окислительных процессах требует оптимальной активности карнитинзависимых трансфераз.
2. Контроль и модуляция внутриклеточного пула CoASH. Помимо переноса активированных ацильных радикалов между компартментами клетки без затраты энергии, карнитиновая система играет также важную роль в сохранении стабильного уровня КоА, который необходим для активирования карбоксилсодержащих метаболитов. Тем самым карнитин включается также в промежуточный обмен в целом, модулируя соотношение ацил-CoA/CoASH и поддерживая необходимый уровень свободного CoASH в клетке. Эта функция карнитиновой системы зависит, главным образом, от образования короткоцепочечных ацилкарнитинов (КЦАКар), катализируемого КАТ [2,7]. Карнитин способствует удалению короткоцепочечных жирных кислот из митохондрии, освобождая внутримитохондриальный СоА, стабилизация уровня которого и функциональная взаимосвязь между пулами СоА и карнитина являются жизненно важными для оптимизации энергетического метаболизма. Участвуя в биохимических процессах обра зования и деградации жирных кислот, стероидов, фосфолипидов, синтезе ацетилхолина, окислении пировиноградной кислоты, образовании кетоновых тел и других процессах, CoASH является важнейшим метаболитом клетки. Он необходим для І-окисления, для катаболизма некоторых аминокислот, для дезинтоксикации органических кислот и ксенобиотиков, для функционирования пируватдегидрогеназы [8], α-кетоглутаратдегидрогеназы [9] и, следовательно, для работы ЦТК [10]. Снижение поступления карнитина вызывает уменьшение содержания СоА в матриксе и сопутствующее этому повышение соотношения ацил-СоА/ CoASH, что вызывает ингибирование ферментативной активности вышеупомянутых дегидрогеназ. Следовательно, ослабляется не только окисление жирных кислот [11], но также и утилизация углеводов, катаболизм некоторых аминокислот, дезинтоксикация органических кислот и ксенобиотиков [12]. Взаимосвязь СоА – карнитин в клетке осуществляется посредством карнитин-ацилтрансфераз [13].
Поскольку защита митохондриального и цитозольного пулов свободного СоА при различных заболеваниях достигается экскрецией ацилкарнитинов, то в тех случаях, когда происходит образование нежелательных ацильных групп, как, например, при некоторых наследственных нарушениях окисления жирных кислот, дополнительный прием L-карнитина является необходимым. В целом терапевтический эффект L-карнитина и его эфиров, по-видимому, во многом опосредован через интегральное влияние карнитиновой системы на пулы СоА.
3. Дезинтоксикация органических кислот и ксенобиотиков. Удаление биогенных «шлаков», накапливающихся в митохондриях в результате окислительного разложения жиров, а также ксенобиотиков — еще одна важная функция L-карнитина. Цитотоксические органические кислоты, как и ксенобиотики, биотрансформируются превращением в производные ацил-СоА, которые удаляются из дальнейшего катаболического процесса. Кроме того, ацил-СоА может накапливаться внутри митохондриального матрикса при дефиците ферментов их деградации. В этом случае трансформация ацил-СоА в соответствующие ацилкарнитины позволяет вывести избыток ацильных остатков из митохондрий в цитозоль. В отличие от соответствующих производных ацил-СоА, ацилкарнитины, в особенности короткоцепочечные, способны диффундировать через клеточные мембраны и могут быть элиминированы в мочу.
4. Анаболические функции. Анаболический эффект L-карнитина был установлен в эксперименте, а также в медицинской и спортивно-медицинской практике без объяснения механизма действия. Возможно, анаболические функции L-карнитина осуществляются путем участия в метаболизме фосфолипидов за счет поддержания оптимального соотношения ацил-CoA/CoASH. Действительно, оборот и восстановление жирно-кислотного состава фосфолипидов мембраны зависит от доступности ДЦАСоА. В этом отношении роль L-карнитина и КПТ двойная: снабжение ацильными остатками без расхода АТР и поддержка клеточного уровня CoASH на необходимом уровне [15].
5. Защитное действие при апоптозе. Участие L-карнитина как в энергетическом метаболизме, так и в обороте фосфолипидов указывает на важнейшую роль этого соединения в поддержании жизнеспособности клетки. В ряде исследований было установлено, что L-карнитин в различных биологических системах оказывает защитное действие при апоптозе. В этот процесс включены различные группы веществ, в частности церамиды – мощные эндогенные промоторы клеточного апоптоза и аспартатспецифические цистеиновые протеазы, называемые каспазами, являющиеся ключевыми медиаторами апоптоза. Протективные свойства L-карнитина при апоптозе обусловлены как ингибированием синтеза церамидов [16], так и активности каспаз [17], и, вероятно, не связаны с функционированием карнитиновых трансфераз. Экспериментально было показано, что введение карнитина в кардиомиоциты, в которых апоптоз был вызван действием доксорубицина, снижает внутриклеточный уровень церамида [16,18]. Ингибирование L-карнитином образования церамидов происходит, по-видимому, в результате действия двух различных механизмов. Так, отвлечение пальмитоил-СоА от синтеза церамидов в окислительный метаболизм [19] усиливает ингибиторный эффект L-карнитина на кислую сфингомиелиназу, которая генерирует образование церамидов в ответ на множественные причины апоптоза [16]. Кроме того, показано, что L-карнитин ингибирует активность каспаз-3 и каспаз-8 [17].
6. Нейрозащитный эффект. Нейрозащитное действие L-карнитина было выявлено у крыс на модели митохондриальных нарушений, вызванных 3-нитропропионовой кислотой (3-НПК). Ранее было показано, что 3-НПК является мощным митохондриальным токсином, который вызывает снижение нейронального уровня АТР через ингибирование сукцинатдегидрогеназы комплекса II митохондриальной транспортной цепи электронов. Предварительный прием L-карнитина крысами полностью предотвращал снижение температуры мозга, вызванное введением 3-НПК. Защитный эффект L-карнитина, по-видимому, обусловлен его митохондриотропными свойствами [20].
В другой серии экспериментов было показано, что некоторые нарушения ЦНС, вызванные амфетамином и метамфетамином (МЕТ), связаны с повышением образования свободных радикалов. Это повышение может быть частично связано с митохондриальными дисфункциями, а, следовательно, приводить к недостаточности энергетического метаболизма в клетке и повышению вторичной эксцитотоксичности. Токсичность метамфетамина связана с повышением образования под его влиянием активных форм кислорода (гидроксил, супероксид, пероксид) и азота (N0). Наиболее опасным радикалом является пероксинитрит, который образуется из N0 и включается в патогенез ряда заболеваний, в частности множественного склероза. Как было показано, токсическое действие метамфетамина приводит, как в опытах in vitro, так и in vivo, к образованию 3-нитротирозина – стресс маркера пероксинитрита. Предположили, что усиление митохондриального энергетического метаболизма, вызываемое L-карнитином, может предотвратить образование пероксинитрита и других свободных радикалов под действием метамфетамина. Действительно, установлено экспериментально, что прием L-карнитина заметно ослабляет образование 3-нитротирозина у экспериментальных животных, которым вводили метамфетамин [21]. Защитный эффект L-карнитина может быть связан с предотвращением нарушения метаболических процессов, вызванных метамфетамином и приводящих к дефициту энергии. Роль L-карнитина в снижении токсичности, вызываемой введением метамфетамина, продолжает изучаться, что дает надежду на возможность его использования в лечении ряда заболеваний нервной системы [22].
В организме человека, животных и различных биологических источниках присутствует L-изомер карнитина, который и участвует в метаболических реакциях в качестве субстрата карнитинзависимых ферментов. Благодаря наличию в структуре асимметрического атома углерода, молекула карнитина, подобно многим биологически активным веществам, может существовать в двух изомерных формах: L- и D-стереоизомеров. В природе D-изомер карнитина не обнаружен и может быть получен только в результате химического синтеза. Многочисленные исследования показали, что D-карнитин является биологически неактивной формой и негативно влияет на различные стороны обмена веществ. Он препятствует окислению жирных кислот в митохондриях и образованию энергии [23,24], конкурентно ингибирует активное усвоение L-карнитина органами и тканями [25,26], а также вызывает нарушение биосинтеза L-карнитина в печени [23]. Как показали специальные исследования, прием D-карнитина в течение двух дней приводит к значительному снижению содержания L-карнитина в печени, сердечной и скелетных мышцах и почках [23]. Также показано, что прием D-карнитина вызывает острую недостаточность L-карнитина в организме, особенно в сердечной и скелетных мышцах, что способствует миастении и сердечной аритмии. Поэтому концепция использования препаратов карнитина в качестве средства метаболической терапии относится к природному L-изомеру и в настоящем обзоре рассматриваются свойства только L-карнитина.
Для человека установить пищевую потребность в L-карнитине (далее карнитин) достаточно сложно и в отличие от большинства известных витаминов не существует официально утвержденной рекомендуемой нормы его потребления. В норме биосинтез карнитина из предшественников у человека составляет от 0,16 до 0,48 мг/кг веса тела в день (не более 50 мг). Среднее его количество в нормированной пище, содержащей мясные продукты, составляет около 100-300 мг. При очень высоком содержании в дневном рационе мясных продуктов можно получить до 1 г карнитина в день. Учитывая его фактическое содержание в пищевых рационах и некоторые другие данные, ученые-диетологи в США пришли к заключению, что норма потребления карнитина должна составлять 20 мг на 1 кг массы тела (1-2 г/день для человека весом 50 и 100 кг соответственно). Приведенные нормы, естественно, дают ориентировочное представление о необходимых пределах поступления карнитина, обеспечивающих нормальное осуществление некоторых жизненных процессов, и имеют усредненный характер. Очевидно, что потребность в карнитине зависит от возраста человека и определяется его соматическим состоянием [27]. В ряде случаев потребность организма в нем существенно возрастает и может достигать 3 г в день (например, у женщин в период беременности и кормления, спортсменов, больных диабетом, у пациентов с болезнями сердца и почек). Использование карнитина в дозах более 50 мг/кг обычно осуществляется в терапии различных заболеваний.
Симптомы недостаточности карнитина разнообразны и неспецифичны. В настоящее время принято считать, что недостаточность карнитина – это метаболическое состояние, при котором его концентрация в плазме и тканях меньше того уровня, который необходим для нормального функционирования организма. Биологический эффект от низкого содержания карнитина может быть клинически незначимым, но только до тех пор пока он не достигнет величины менее 10-20% от нормы. Содержание общего карнитина в плазме у здоровых людей составляет от 30 до 89 мкмоль/л (у мужчин 59,3±11,9 мкмоль/л, у женщин 51,5±11,6 мкмоль/л) и может быть довольно точно определено ферментативным методом [28].
Впервые карнитиновая недостаточность человека была обнаружена и описана в научной литературе только в 1973 г. у 19-летней девушки, страдавшей миопатией. С тех пор многочисленные исследования, проводимые за рубежом, а в последние годы также и в России, однозначно показывают существование фактической недостаточности карнитина, которая вызывается неполноценным питанием, нарушением его биосинтеза или всасывания, врожденными или приобретенными нарушениями обмена веществ, заболеваниями печени и почек [29,30]. Причиной карнитиновой недостаточности может быть также повышенная потеря карнитина в результате гемодиализа, длительного физического или нервно-психического напряжения, побочного действия различных лекарств. Некоторые больные не могут в полной мере синтезировать карнитин из-за нарушения ферментных систем его биосинтеза вследствие генетических дефектов, старения организма или различных патологических состояний. Известны случаи, когда достаточное количество карнитина циркулирует в кровяном русле, но не поступает в мышечные ткани.
Карнитиновая недостаточность (КН) разделяется на первичную и вторичную. Первичная КН наследуется по аутосомно-рецессивному типу. Вероятно, она связана с нарушением механизма транспорта карнитина из циркуляторной системы в клетки тканей и вызывается дефицитом в плазменной мембране Na+-зависимого белка-транспортера карнитина (0CTN2) [31]. При этом происходит выделением карнитина с мочой, вызывающее выраженное снижение его уровня в тканях. Внутриклеточная КН ослабляет вхождение длинноцепочечных жирных кислот в митохондриальный матрикс. Следовательно, они становятся недоступны для І-окисления и образования энергии, а также ослабляется образование кетоновых тел (которые используются мозгом). Нарушена также регуляция уровня внутримолекулярного свободного СоА с накоплением ацил-СоА в митохондриях. Это, в свою очередь, нарушает различные пути промежуточного обмена, для которых требуется СоА.
При КН нарушается работа трех основных систем организма:
Мышечная КН (ограниченная мышцами) характеризуется снижением уровня карнитина в мышцах и обычно нормальным уровнем в плазме. Данные исследований указывают, что причиной этого является дефект в мышечном кар-нитиновом переносчике, что клинически характеризуется медленно прогрессирующей мышечной слабостью, гипотонией или атонией, атрофией. На поздних стадиях развивается сердечная недостаточность [32].
Системная КН характеризуется снижением уровня карнитина в плазме и тканях. Нарушен транспорт карнитина в скелетные мышцы, а возможно и в сердечную мышцу, фибробласты и почечные канальцы, что клинически проявляется тяжелой гипогликемией, печеночной энцефалопатией по типу синдрома Рейе, тяжелой кар-диомиопатией [33].
Вторичная КН может быть врожденной и приобретенной, но в обоих случаях она характеризуется снижением биодоступности свободного карнитина. Врожденная КН вызывается различными метаболическими заболеваниями (например нарушением окисления жирных кислот или расщеплением аминокислот, вызывающих органические ацидурии). В этом случае снижение уровня карнитина может быть вторичным по отношению к образованию ацилкарнитиновых аддуктов и ингибированию карнитинового транспорта в почечных канальцах ацилкарнитинами [34].
При нарушениях окисления жирных кислот происходит чрезмерное накопление жиров в мышцах, сердце и печени с кардиальной или скелетной миопатией и гепатомегалией. При органической ацидурии (пропионовая, метилмалоновая, изовалериановая) возможно накопление ацил-производных СоА внутри митохондрий, что клинически выражается мышечной слабостью, дискоординацией, замедлением роста. Длинноцепочечные ацилкарнитины являются, как и ацил-СоА, токсичными соединениями и могут оказывать аритмогенный эффект, вызывающий внезапную остановку сердца.
Энцефалопатия может быть вызвана снижением доступности кетоновых тел, связанной с гипогликемией. Следует отметить дефицит карнитина у детей раннего возраста, особенно у недоношенных детей. Дети раннего возраста обладают недостаточной способностью накапливать карнитин и относительно неразвитой системой его биосинтеза и, в то же время, в этом возрасте жиры являются главным источником энергии для сердечной и скелетных мышц (в женском молоке до 40% общей калорийности приходится на жиры). В этом случае карнитин абсолютно необходим. Поэтому дети в значительной степени зависят от экзогенного снабжения карнитином и для достижения нормального уровня в плазме они должны получать с пищей относительно большое его количество [35].
В основе приобретенной вторичной КН лежит целый ряд причин: заболевания почек или печени, в которых осуществляется биосинтез карнитина, повышенное его выведение при гемодиализе, приеме некоторых лекарств, при метаболизме которых образуются органические кислоты, недостаточное поступление с пищей карнитина или аминокислот, необходимых для его образования (парентеральное или вегетарианское питание), повышенный расход карнитина (стресс, физические нагрузки, беременность, ишемические поражения, травма и т.д.).
Целый ряд лекарств по своей химической природе являются органическими кислотами или их производными и удаляются из организма в форме эфиров карнитина. Отмечено, что длительный прием препаратов вальпроевой кислоты, пивалоилсодержащих и антрациклиновых антибиотиков, сульфадиазина, ибупрофена и ряда других лекарств приводит к значительному снижению содержания карнитина в плазме крови и может вызывать приобретенный тип вторичной КН.
Метаболическая роль карнитина была расшифрована в течение последних 30 лет, причем значительная часть наших знаний о его биохимических особенностях и терапевтической эффективности получена из клинических наблюдений за пациентами, страдающими от карнитиновой недостаточности или различных митохондриальных патологий. Основная функция карнитина — энергетическая. Поэтому при снижении его биодоступности или ослаблении активности карнитинзависимых трансфераз нарушается процесс окисления жирных кислот, что, исходя из клинической точки зрения, приводит в наиболее серьезных случаях к опасным для жизни нарушениям в скелетных и сердечной мышцах.
Лечение первичной и вторичной КН долгое время оставалось серьезной проблемой, главным образом в связи с трудностью диагностики КН и нарушений метаболизма карнитина. Однако в последние годы в этом аспекте наметился заметный прогресс и сегодня адекватная диагностика и достаточный клинический опыт лечения пациентов с различными типами КН позволяют эффективно выводить из патофизиологических состояний, связанных с дефицитом карнитина.
Как уже отмечалось, первичная КН вызывается мутацией в гене карнитинового транспортера OCTN2 [31,36]. Патология транспорта карнитина приводит к выбросу его в мочу и снижению его внутриклеточного накопления. Начальные симптомы появляются в возрасте от 1 месяца до 7 лет. Клинические проявления довольно разнообразны. К сожалению, первым проявлением бессимптомного течения болезни при первичной КН может быть внезапная смерть [37]. Для детей раннего возраста типично наличие острой энцефалопатии, сопровождающейся гипокетозными гипогликемическими эпизодами. Если не принимать карнитин, то могут последовать повторяющиеся приступы энцефалопатии. У больных с первичной КН развивается прогрессирующая кардиомиопатия, которая обычно присутствует в более позднем возрасте. Сердечная функция не реагирует на инотропы или диуретики, тогда как применение карнитина ведет к выраженному клиническому эффекту. Еще одним проявлением КН являются слабость и атрофия мышц, которые могут сопровождаться сердечной недостаточностью или присутствовать самостоятельно. Первичная КН может вызывать нарушение желудочно-кишечной моторики с повторяющимися приступами боли в желудке и диареей. Другими проявлениями болезни являются гипохромная анемия и повторяющиеся инфекции. При первичной КН может наблюдаться также резкое снижение уровня карнитина в мышцах при нормальном его содержании в сыворотке. Симптомы мышечной КН наблюдаются в первые годы жизни, но они могут появиться и позднее в течение второй или третьей декады. Больные могут ощущать мышечную слабость различной степени, непереносимость физических нагрузок или миалгию.
Вторичная КН встречается достаточно часто и ее причины, как уже отмечалось, более многообразны. Она наблюдается при некоторых генетически детерминированных нарушениях обмена веществ, в том числе органических ацидемиях, патологии транспорта и окисления жирных кислот, а также аминокислот с разветвленной цепью [38]. В этих случаях низкий уровень карнитина в крови и тканях обусловлен этерификацией значительной части запасов карнитина, что снижает накопление специфических производных ацил-СоА, вызывающих ферментативный дефект.
Перенос неметаболизируемого ацильного остатка от СоА к карнитину имеет 2 главных преимущества:
Повышенное содержание специфических ацилкарнитинов в плазме или моче может быть характерным диагностическим маркером для некоторых наследственных заболеваний обмена веществ, например изовалериановой или пропионовой ацидемии. Такой анализ должен стать стандартным в клинической практике.
Признаки приобретенного вторичного карнитинового дефицита сходны с метаболическими изменениями, описанными для первичных карнитинзависимых дефектов. Различные приобретенные заболевания или неблагоприятные условия могут сопровождаться нарушениями гомеостаза карнитина. Цирроз печени, гепатит, хроническая почечная недостаточность, диета с низким содержанием карнитина (например молочно-яично-вегетарианская диета), синдром пониженного всасывания, недоношенность плода могут вызвать вторичную КН [39, 40]. Повышенное выведение карнитина с мочой и снижение его уровня в тканях наблюдается при почечном тубулярном ацидозе, синдроме Фанкони [28, 40], а также в условиях повышенного катаболизма, присутствующего у больных с тяжелыми заболеваниями.
Особо следует отметить вторичную КН у больных, находящихся на долговременном (периодическом) гемодиализе, поскольку при диализе карнитин и большинство его предшественников удаляются из кровеносной системы. Нарушенный синтез карнитина в почках также способствует появлению КН у пациентов с почечной недостаточностью, находящихся на диализе. В ряде исследований было выявлено, что у таких пациентов может быть нормальный уровень карнитина в плазме, но при этом всегда имеется заметный дефицит в мышцах, который проявляется мышечными спазмами, судорогами, астенией. У некоторых пациентов развивается кардиомиопатия (вплоть до сердечной недоста точности), часто отмечается также липопротеинемия и гипертриглицеридемия. Лечение карнитином в большинстве случаев приводит к клиническому и биохимическому улучшению, а также к восстановлению нормальной концентрации различных фракций карнитина в ткани и крови. В ряде исследований было показано, что пероральный прием карнитина значительно повышает показатели гематокрита (с 25,5 до 37,3%), увеличивает количество эритроцитов и концентрацию гемоглобина. Применение карнитина позволяет значительно снизить (более чем на 30%) количество эритропоэтина, принимаемого для поддержания уровня гематокрита в терапии анемии, возникающей у больных на фоне гемодиализа [41]. Фармакологическая коррекция карнитином снижает риск нарушения функций сердечно-сосудистой системы, которое часто наблюдается у пациентов с хроническим гемодиализом. В настоящее время при хроническом и остром гемодиализе рекомендуется назначение карнитина (после процедуры внутривенно вводится от 2 до 4 г), что значительно улучшает качество жизни пациента [42].
Дефицит карнитина в тканях во многих случаях может быть связан с нарушением питания, поскольку его уровень в организме зависит не столько от эндогенного синтеза, сколько от поступления с пищей карнитина и аминокислотных предшественников его биосинтеза, а также некоторых витаминов. Только около 10% общей потребности в карнитине удовлетворяется за счет собственного синтеза в организме. При этом для образования только 1 г карнитина необходимо около 30 г белка в качестве источника двух незаменимых аминокислот – лизина и метионина. Если диета включает в себя слишком малые количества карнитина и белка, то при высоком уровне энергетических потребностей происходит нарушение азотистого баланса. Причинами нарушения поступления карнитина в организм могут быть пониженное питание (голод), синдром нарушенного всасывания (мальабсорбция), заболевания кишечника, приводящие к нарушению всасывания, парентеральное питание и искусственное вскармливание (у новорожденных). Некоторые болезни, стрессы, беременность и кормление грудью, интенсивные физические нагрузки могут значительно повысить потребность в карнитине и требуют дополнительного его поступления за счет питания или потребления карнитинсодержащих препаратов. Нарушение поступления карнитина с пищей, особенно у новорожденных и детей до 3 лет, у которых интенсивность биосинтеза составляет лишь 12% от биосинтеза взрослых, может привести к его дефициту. Недоношенные новорожденные имеют дополнительный риск развития КН, поскольку у них ослаблен процесс реабсорбции карнитина на уровне проксимальных ренальных тубул, а биосинтез карнитина резко ограничен в связи с небольшой мышечной массой. Развитие "функциональной" КН в отдельные периоды жизни явилось патогенетическим основанием назначения карнитина.
Показан высокий анаболический эффект у 20%-го водного раствора карнитина ("Элькар") при его пероральном применении. В одном из исследований, под наблюдением находились недоношенные дети, в том числе с массой тела при рождении менее 1500 г, у которых отмечалось снижение уровня карнитина. У детей, принимавших указанный препарат, повысился аппетит, происходила ежемесячная прибавка веса и увеличения роста, причем наиболее выраженной она была у детей с массой тела при рождении менее 1000 г. Отмечено повышение двигательной активности и улучшение реакции захвата предметов. Кроме того, достаточный уровень карнитина оказывал поддержку в полноценном развитии легких [43].
В другом исследовании, проведенном также в России, было отмечено, что "Элькар" способствует прибавке веса и у детей доношенных, но родившихся с малой массой тела (менее 2500 г). При этом также повышался коэффициент усвоения белка и увеличивался уровень белка сыворотки крови. На фоне лечения ни у одного ребенка не развилась ранняя анемия и повысился уровень гемоглобина [44]. Эти данные свидетельствуют о больших возможностях карнитина в коррекции состояния недоношенных детей и целесообразности его назначения всем детям в первые месяцы жизни.
Вторичная КН обнаруживается у больных при длительной терапии различными препаратами, метаболизм которых приводит к образованию органических кислот. Клинические исследования показали, что у больных, принимающих вальпроаты, отмечается значительное снижение содержания свободного и общего карнитина в плазме, по сравнению с группой больных, получающих другие противосудорожные препараты. Это связано, в первую очередь, что образуется вальпроил-СоА, вызывающий секвестирование свободного СоА и накопление соответствующего ацил-СоА, а карнитин, выступая в качестве модулятора, выводится с мочой в форме вальпроилкарнитина. Описано также прямое ингибирование ферментов окисления жирных кислот метаболитами вальпроевой кислоты. Кроме того, отмечена корреляция между концентрацией вальпроевой кислоты и степенью гипераммониемии. Таким образом, терапия вальпроатами вызывает серьезные побочные эффекты, среди которых развитие синдрома Рейе, гипераммониемия, токсическое поражение печени, панкреатиты [45,46]. Прием карнитина приводит не только к нормализации его уровня в плазме крови, но также и к нормализации внутриклеточного пула СоА, снижению содержания аммиака и улучшению клинической картины основного заболевания. Кроме того, исследования показали, что терапия карнитином уменьшает негативное действие вальпроевой кислоты на интеллект и восприимчивость к обучению. При этом карнитин не снижает концентрацию вальпроевой кислоты в плазме и ее клинический эффект, а согласно некоторым исследованиям даже улучшает ее контролирующее действие в отношении эпилептических припадков.
Другим большим классом лекарств, использование которых приводит к появлению в моче больных избытка ацилкарнитина и снижению концентрации карнитина в плазме и мышцах до 10% от нормы, являются пивалоилсодержащие антибиотики. Понижение уровня карнитина было также отмечено и у пациентов, принимавших антрациклиновые антибиотики, сульфадиазин, ибупрофен и ряд других лекарств. Поэтому в случаях длительных курсов лечения вышеуказанными лекарствами целесообразно назначение адекватной профилактической дозы карнитина (обычно 10-50 мг/кг в день) [47]. Описан случай резкого снижения уровня карнитина у 72-летнего пациента, страдающего эпилепсией. Поскольку у больного было выявлено инфицирование мочевого тракта, то ему кроме вальпроата давали пивмециллин. Через несколько дней после приема антибиотика у больного развилась гипераммониемическая энцефалопатия, вызванная тем, что оба препарата снижали концентрацию карнитина в сыворотке крови [48].
Некоторые лекарства, применяемые для лечения СПИДа, например зидовудин, могут вызывать у больных отрицательные явления, включая лактатацидоз [49]. Вполне вероятно, что мышечная митохондриальная недостаточность, наблюдаемая после приема зидовудина, происходит в результате снижения содержания мышечного карнитина и вызывает понижение его усвоения в мышцах. В этом случае показано использование карнитина.
Кроме указанных выше примеров прямой связи между карнитином и митохондриальными заболеваниями, по-видимому для большинства этих болезней характерен относительный дефицит карнитина, что значительно осложняет течение и прогноз основных заболеваний и требует во многих случаях коррекции метаболизма карнитина. Например, любой дефект дыхательной цепи снижает доступность окисленных коферментов, в результате чего уменьшается скорость окисления и наблюдается накопление промежуточных продуктов обмена. В этих условиях значительная часть свободного карнитина превращается в ацилкарнитины, и не участвует в процессе образования ацетил-СоА. С другой стороны, снижение скорости І-окисления приводит к накоплению ДЦАСоА и, следовательно, соответствующих эфиров карнитина. Для таких митохондриальных болезней как синдром Кернса-Сейра, прогрессирующая офтальмоплегия и др. установлен относительный дефицит карнитина – повышенная потребность в нем связана именно с тяжелыми расстройствами электронного транспорта и окислительного фосфорилирования [50,51].
Недавние исследования, проведенные в отделе наследственных и врожденных заболеваний Института педиатрии и детской хирургии (г. Москва) доказали наличие недостаточности карнитина при ряде форм наследственных метаболических заболеваний. Уровень карнитина в крови оказался низким у 16 детей, страдающих различными формами наследственной патологии, в частности митохондриальным синдромом Кернса-Сейра (3 ребенка) и Барта (1), нарушением окисления жирных кислот (4), изовалериановой ацидемией (1), синдромом Марфана (4) и аутоиммунным полиэндокринным синдромом типа I (3). Возраст больных составлял 3-14 лет. Содержание общего карнитина в крови у детей колебалось от 1,6 до 41,1 мкмоль/л, в среднем – 15,8±3,6 мкмоль/л. В контрольной группе (дети, не имевшие клинических признаков недостаточности карнитина) уровень его был в пределах 41-148 мкмоль/л и в среднем достигал 72,8±11,7 мкмоль/л.
Для коррекции дефицита карнитина наблюдаемым больным назначали препарат "Элькар" [52,53], дозы которого составляли 20-30 мг на 1 кг массы тела в сутки. Ребенку с изовалериановой ацидемией была назначена более высокая доза из расчета 50 мг на 1 кг массы тела. У всех больных "Элькар" был применен дополнительно к основному лечению и лишь в случае болезни Марфана данный препарат был использован в качестве монотерапии. Помимо оценки клинического статуса больных у 10 детей через 4 недели после назначения "Элькара" проводили контроль изменения уровня карнитина в крови, который показал достоверное увеличение этого показателя (в среднем в 3 раза). Среднее содержание общего карнитина в сыворотке крови у больных превысило нижнюю границу нормы, а у отдельных пациентов приблизилось к параметрам контрольной группы. Увеличение уровня карнитина в крови сочеталось с улучшением состояния и самочувствия детей, снижением утомляемости, уменьшением выраженности миопатического синдрома, улучшением походки и координации движений, прекращением приступов метаболической декомпенсации. Полученные результаты свидетельствуют, что при большинстве форм генетически детерминированной патологии обмена веществ необходима ликвидация карнитиновой недостаточности, что требует достаточно длительного применения карнитинсодержащих препаратов. В настоящее время препараты карнитина разрешены для лечения врожденных нарушений обмена веществ, связанных, в частности, с накоплением аномальных производных ацил-СоА.
Таким образом, данные экспериментальных и клинических исследований показывают, что карнитиновая недостаточность встречается достаточно часто и поэтому необходимо проводить диагностику этого состояния при различных заболеваниях, а при наличии дефицита карнитина осуществлять его коррекцию. Опыт клинического применения препаратов карнитина подтверждает их высокую эффективность при лечении синдромов КН, включая митохондриальные заболевания и врожденные нарушения обмена.
В течение многих лет карнитин является весьма популярной биологически активной добавкой, используемой в спортивной медицине для повышения физической работоспособности, в системе коррекции веса и в молочных смесях для детского питания [1].
Карнитин участвует не только в окислении жирных кислот, но также вносит заметный вклад и в метаболизм углеводов. Это дает основание использовать его в лечении ишемической болезни сердца наряду с группой метаболических модуляторов, таких как ранолизин, триметазидин, дихлорацетат, глюкозо-инсулино-калиевая смесь, механизм действия которых отличается от такового для традиционных противоишемических препаратов [54]. Действие этих веществ направлено на установление баланса в использовании миокардом пирувата (глюкозы) и жирных кислот в качестве источника энергии. Сердце представляет собой своеобразный насос, энергию для которого поставляют свободные жирные кислоты и углеводы, однако в нормальных физиологических условиях жирные кислоты являются предпочтительным источником энергии. В обоих случаях конечным продуктом окисления является ацетил-СоА, который в митохондриях включается в ЦТК с образованием энергии в форме АТР. В обычных условиях при нормальном поступлении кислорода жирные кислоты являются основным субстратом для выработки энергии в миокарде (до 60-80%), при этом существует равновесие между окислением жирных кислот и гликолизом. В случае ишемии кислород используется в основном для окисления жирных кислот как основного источника ацетил-СоА, причем окисление в условиях недостаточности кислорода происходит не полностью, что приводит к накоплению жирнокислотных производных СоА, включая ацетил-СоА. Последний является ингибитором пируватдегидрогеназного комплекса (ПДК). При нарушении кровообращения (ишемии) повышается активность анаэробного гликолиза, в котором глюкоза превращается в лактат с образованием двух молекул АТР. В экспериментальных работах показано, что стимуляция анаэробного гликолиза дает возможность миокарду лучше использовать остаточный кислород и положительно влиять на работу сердца в условиях ишемии [54]. Таким стимулятором и является карнитин, который способствует удалению ацетил-СоА из митохондрий.
Как это происходит? Как уже отмечалось, карнитин, взаимодействуя с СоА, оказывает заметное влияние практически на все СоА-зависимые процессы. В частности карнитин участвует в превращении ацетил-СоА в ацетилкарнитин и таким образом удаляет мощный ингибитор ПДК. Это было подтверждено в экспериментах на изолированных митохондриях сердца, где добавление карнитина в среду инкубации активировало ПДГ [55]. Повышение активности ПДК увеличивает скорость окисления глюкозы и улучшает сопряжение процессов гликолиза и аэробного окисления глюкозы. Поэтому неудивительно, что при высокой биодоступности карнитина окисление жирных кислот в сердце снижается и усиливается окисление глюкозы. Часть такой стимуляции происходит благодаря образованию малонил-СоА, который снижает вход ацил-СоА в митондриальный матрикс путем ингибирования КПТ I [56]. Снижение активности КПТ I ограничивает транспорт жирных кислот в митохондрии и, следовательно, их окисление. Малонил-СоА образуется в результате карбоксилирования ацетил-КоА, ацетильные группы которому доставляет ацетилкарнитин. Таким образом, карнитин, стимулируя образование ацетилкарнитина, в конечном счете снижает окисление жирных кислот в сердце и этот эффект оказывает положительное влияние на различные нарушения в ишемизированном миокарде. Действительно, было показано, что улучшению сократительной функции ишемического миокарда способствует высокая степень окисления глюкозы, в то время как повышенный уровень окисления липидов ее подавляет [57,58]. По-видимому, введение карнитина может быть весьма полезным не только при гипоксии, но и при других состояниях, когда низкий уровень CoASH тормозит окисление пирувата, как это имеет место, например, в ситуациях лактат-ацидоза, повышенной физической нагрузки и интоксикации этанолом.
Гипоксия или ишемия приводит также к повышению соотношения этерифицированный/ свободный карнитин [59]. Этот метаболический сдвиг, который воспроизводит аналогичную модификацию статуса СоА, вызывается ингибированием митохондриальных дегидрогеназ из-за избытка восстановленных флавиновых и пиридиновых коферментов. Сниженная скорость І-окисления и ЦТК приводит к тому, что СоА сохраняется в форме его ацильных производных, а весь доступный карнитин действует как акцептор ацилов, освобождая СоА. По-видимому, такое поведение карнитина будет благоприятным для утилизации пирувата. Действительно, в гипоксической ткани пируват главным образом превращается в лактат вследствие ингибирования ПДГ. Снижая соотношение ацетил-СоА/СоА, карнитин может стимулировать активность ПДГ, отвлекая пируват от его восстановления в лактат и вызывая его окисление в ацетил-СоА, а затем — превращение в ацетилкарнитин.
Участвуя в модуляции соотношения ацил-СоА/СоА, карнитин позволяет избежать неблагоприятного эффекта накопления жирных кислот в гипоксических тканях. Глубокие изменения в митохондриях, которые накапливаются при ишемии, вызываются действием ДЦАСоА. Эти эфиры могут войти в двойной фосфолипидный слой, изменяя как архитектуру мембран, так и ее проницаемость [60]. Такие изменения более вероятны в тех условиях, когда концентрация ДЦА-СоА выше критической клеточной концентрации, которая в случае пальмитоил-СоА составляет ~ 30 мкМ. При более низких концентрациях ДЦАСоА может специфически влиять на активность различных транспортных систем внутренней митохондриальной мембраны без нарушения ее проницаемости. Добавление карнитина способно восстановить митохондриальные функции, превращая ДЦАСоА в ДЦАКар, который не обладает ингибиторным эффектом.
В изолированных митохондриях, также как и в интактном сердце, токсичность ДЦАСоА может быть связана, по крайней мере частично, с уменьшением доступности CoASH. Роль соотношения CoASH/ацил-СоА и карнитин / ацилкарнитин в развитии ишемических повреждений была изучена на различных экспериментальных моделях, в частности на перфузированном сердце крысы [55].
В ряде исследований показано, что фармакологические агенты, оказывающие прямое благотворное влияние на энергетический метаболизм миокарда, являются эффективным средством для лечения ишемической болезни сердца. Среди них имеются такие агенты, которые сдвигают метаболизм кардиомиоцитов с жирнокислотного на углеводный путь благодаря ингибированию КПТ I. Как было показано, ингибиторы КПТ I предохраняют от нежелательных эффектов, вызванных механическими перегрузками, например при кардиальной гипертрофии и сердечной недостаточности. Поэтому регулирование активности КПТ I с помощью ее ингибиторов открывает широкие возможности еще одного метаболического подхода для лечения сердечно-сосудистых заболеваний и, в частности, сердечной недостаточности на основе карнитиновой системы. Поскольку при сахарном диабете замедление окисления жирных кислот препятствует ишемическому повреждению миокарда, ингибиторы КПТ I могут быть также эффективными при лечении диабетической кардиомиопатии [61].
Эффективность препаратов карнитина в лечении некоторых сердечно-сосудистых заболеваний, включая ишемическую болезнь сердца, подтвержденная в значительном числе экспериментальных и клинических исследований, по-видимому не связана с более интенсивной утилизацией жирных кислот, как часто указывается в ряде работ, а вызвана более сложными биохимическими меха низмами.
Итальянские исследователи первыми продемонстрировали, что введение карнитина может снизить образование лактата у больных с коронарными заболеваниями или перемежающейся хромотой [62]. У здоровых добровольцев во время физической нагрузки на велоэргометре было также отмечено, что уровень лактата находится в обратно пропорциональной зависимости от уровня ацетилкарнитина [63]. В дальнейшем было показано, что фармакологическая коррекция энергетического метаболизма миокарда с использованием карнитина приводит к выраженному позитивному эффекту как в условиях ишемии, так и в условиях реперфузии.
Таким образом, положительное влияние карнитина на течение инфаркта миокарда обусловлено как улучшением энергетического метаболизма, так и уменьшением зоны ишемических поражений. Это открывает новые возможности применения карнитина для лечения ишемической болезни сердца и инфаркта миокарда. Установлено, что при стенокардии прием карнитина повышает устойчивость к нагрузкам, уменьшает частоту приступов и уменьшает потребность в нитроглицерине и других антиангинальных средствах. Американская ассоциация кардиологов по лечению больных со стабильной стенокардией относит карнитин к антиангинальным препаратам. При инфаркте миокарда карнитин улучшает динамику ЭКГ, уменьшает площадь некроза, снижает количество эпизодов аритмии.
По данным ряда исследований [64] установлено, что при нарушениях сердечного ритма прием карнитина позволяет уменьшить количество используемых антиаритмических препаратов, а также значительно снижает количество желудочковых экстрасистол. Учитывая, что карнитин является хорошо переносимым и безопасным агентом и не влияет на показатели гемодинамики, он может быть использован в качестве дополнительного препарата к традиционной противоишемической терапии без какого-либо риска.
Кардиомиопатии, особенно у детей, относятся к тяжелой форме патологии миокарда. Во многих исследованиях показано, что кардиомиопатии сочетаются с резким снижением уровня карнитина в митохондриях. Назначение карнитина в дозе 50-100 мг/кг в течение 3-6 месяцев при карнитиновой кардиомиопатии позволяет нормализовать размеры сердца, компенсировать сердечную недоста точность [30]. При митохондриальных кардиомиопатиях, сопровождающихся нарушениями митохондрий и обусловленных дефектами синтеза и транспорта карнитина, а также органическими эпидемиями, применение карнитина способствует значительному клиническому улучшению, а в ряде случаев и обратному развитию кардиомиопатий. По мнению ведущих российских кардиологов, применение карнитина должно обязательно входить в комплексную терапию сердечной недостаточности у больных с различными видами кардиомиопатий [65].
В основе медицинского применения эфиров карнитина лежит их способность проходить через клеточные мембраны и поступать в матрикс митохондрий при экзогенном введении. Здесь они превращаются в соответствующие ацил-СоА, которые могут участвовать в митохондриальном обмене веществ с образованием дополнительного количества энергии. Кроме того, эфиры карнитина обеспечивают некоторую степень специфичности при терапии карнитином. В настоящее время наиболее широко изучено применение в медицинской практике ацетилкарнитина [66] и, в меньшей степени, пропионил-, изовалерил- и пальмитоилкарнитина.
Биологическое действие АЛК во многом обусловлено метаболическими эффектами карнитина и ацетильной группы, входящих в состав его молекулы. По сравнению с карнитином, АЛК более эффективно поступает в кровоток, легче проникает через клеточные мембраны, включая гематоэнцефалический барьер, и более эффективно утилизируется митохондриями. При внутривенном введении (333 мг/кг) пик концентрации АЛК в крови у крыс достигается через 5 мин и составляет 5375 мкмолей/л, а затем снижается в последующие 6 часов до 106 мкмолей/л. При пероральном приеме (500 мг/кг) пик концентрации препарата в крови наступает через 4 ч, составляет 40 мкмолей/л и сохраняется таким в течение 8 часов. Определены фармакокинетические показатели после одноразового перорального приема таблетки АЛК (500 мг) 8 здоровыми добровольцами: период полувыведения был равен 4,2 ч, а время достижения максимальной концентрации в крови – 3,1 ч [67].
Всасывание АЛК из желудочно-кишечного тракта происходит за счет активного его транспорта или путем простой диффузии через слизистую оболочку (при условии его высокой концентрации). В большинство тканей, включая церебральную, АЛК поступает из плазмы крови с участием транспортера OCTN2 (исключение составляют печень и тонкий кишечник) в неизмененном виде. В клетку АЛК поступает за счет прямого энергозависимого процесса против градиента концентрации. Выводится из организма почками.
Фундаментальные исследования последних лет показали, что АЛК является одним из наиболее эффективных веществ, поддерживающих клеточную энергетику организма. Действительно, поскольку АЛК поставляет уже активированные ацетильные группы непосредственно в митохондриальный матрикс, в котором образующийся из него ацетил-СоА может быть окислен в ЦТК без дополнительного расхода энергии, то он представляет собой наиболее легко доступный субстрат, способный запустить митохондриальные процессы образования энергии. Кроме этого, ацетильная группа этерифицированного карнитина является также предшественником в цитозольном синтезе структурных липидов.
В экспериментальных и клинических исследованиях было установлено, что терапевтическое действие АЛК в значительной степени отличается от действия карнитина. Кроме уже указанных свойств, он влияет еще на работу мозга, улучшая память, настроение и познавательные функции, поддерживает нормальное функционирование иммунной системы [68], снижает образование загрязняющего клетки пигмента,называемого липофусцином [69], и обладает еще рядом полезных свойств, которые здесь будут кратко рассмотрены.
Абсолютная потребность нейрона как в оптимальном митохондриальном метаболизме, так и в сохранении структурной целостности плазматических мембран, от которых зависит не только сохранение клетки, но также и нейротрансмиссия, превращает нейроны в предпочтительную мишень для метаболического действия АЛК. Это предпочтение усиливается тем фактом, что АЛК, являясь предшественником ацетилхолина и обладая структурным сходством с ним, оказывает холиномиметическое действие [70].
Помимо влияния на различные этапы холинергической передачи, АЛК проявляет еще ряд положительных эффектов. Он повышает экстра-целлюлярный уровень аспартата, глютамата и таурина [71]. Имеются данные о способности АЛК при хроническом введении увеличивать плотность NMDA-рецепторов в гиппокампе, коре и стриатуме и препятствовать уменьшению их числа в условиях старения [72]. Установлена способность АЛК усиливать действие не только ацетилхолина, но также и серотонина [73].
Широкий спектр нейрохимических свойств АЛК проявляется в реализации его нейроповеденческих эффектов. В частности, АЛК улучшает процессы памяти, нарушенной скополамином в тесте водного лабиринта Морриса [74]. Результаты экспериментальных исследований, проведенных нами, показали, что АЛК обладает антиамнестической активностью, способностью улучшать процессы обучения, показатели неассоциативной памяти, оказывать позитивный эффект на мнестические функции в условиях экспериментальной модели болезни Альцгеймера, не вызывая при этом побочных эффектов седативного и миорелаксантного характера.
Как энергозависимые, так, холинергические и ноотропные свойства объясняют положительные эффекты, оказываемые АЛК на замедление нейродегенера тивных возрастных заболеваний, включая болезнь Альцгеймера [75]. С другой стороны, клинические улучшения, наблюдаемые при периферической нейропатии, включая диабетическую нейропатию, вероятно, связаны с метаболическим действием АЛК [76]. Таким образом, имеющиеся данные показывают, что АЛК не только необходим для нормальной работы мозга, но и оказывает нейрозащитное действие против ряда токсинов.
Наиболее значимый фармакологический эффект АЛК связан с замедлением процессов старения, который обусловлен усилением транспорта жирных кислот в митохондрии и поддержанием их работы на уровне молодого организма. В соответствии с современными представлениями одной из основных причин старения организма являются митохондриальные нарушения и, как следствие, недостаточность энергетического обмена. При старении окислительный стресс усиливается, а образование макроэргических соединений, обеспечиваемое работой митохондрий, заметно ослабляется, и это является одним из наиболее значимых факторов патогенеза нейродегенеративных заболеваний, таких как болезнь Альцгеймера и других типов деменций, болезнь Паркинсона, эпилепсия, рассеянный склероз и др.
Повреждение митохондрий обусловлено накоплением деструктивных свободных радикалов – побочных продуктов нормального метаболизма, которые выводят из строя ДНК, липиды, ферменты и другие важные соединения. В частности, снижается активность ключевого митохондриального фермента, КАТ, ответственного за утилизацию жирных кислот и образование энергии. Поскольку при участии этого фермента синтезируется АЛК, то его образование в организме при старении заметно снижается. При этом уменьшается снабжение организма энергией и ему приходится работать на "голодном пайке". Многочисленные исследования показали, что применение АЛК для стимулирования образования энергии клетки и нормального функционирования мозга очень эффективно. В экспериментах, выполненных на старых крысах, выявлены антиоксидантные свойства АЛК, прием которого предотвращал свойственное старению усиление свободнорадикального пероксидного окисления в мозговой ткани, приводящее к ее разрушению. Исследования, проведенные американскими учеными, иллюстрируют уникальную способность АЛК повышать клеточное дыхание на моделях старения. Так, изучены особенности паренхиматозных клеток печени у старых крыс после приема 1,5%-го раствора АЛК в течение 1 месяца. Полученные результаты показывают, что введение АЛК в значительной степени восстанавливает возрастные нарушения митохондриальных мембранных функций [77,78]. Исследователями были получены впечатляющие данные о возрастных изменениях клеточной энергетики в митохондриях сердца крыс. Прежде всего, было отмечено, что у старых крыс на 40% подавлены как процессы клеточной энергетики, так и клеточного дыхания; содержание кардиолипина, который является наиболее характерным фосфолипидом митохондрий и участвует в транспорте митохондиальных субстратов, также было значительно снижено [79]. Прием АЛК привел к тому, что частота сердечных сокращений и содержание кардиолипина почти полностью восстанавливались до уровня, наблюдаемого в контроле у молодых животных. Это изучение в значительной степени позволяет объяснить причины благоприятного эффекта АЛК при лечении застойной сердечной недостаточности у человека.
В одном из исследований было установлено, что у старых крыс общее содержа ние карнитина в тканях сердца, скелетных мышцах, коры головного мозга и гиппокампе на 20% ниже, чем у молодых животных. Прием АЛК повышает уровень карнитина у старых крыс, но не оказывает влияния на его содержание у молодых животных. При этом было отмечено, что АЛК снижает избыток триглицеридов и холестерола у старых крыс, и, что важно, АЛК снижает повышенный общий уровень холестерола и соотношение холестерол / фосфолипиды в их мозговой ткани. Полученные результаты показывают, что длительное введение АЛК делает обратимыми возрастные нарушения обмена липидов [80].
Исследования последних лет показывают, что АЛК может быть использован для эффективного лечения заболеваний головного мозга и физиологических изменений ЦНС, вызванных в том числе и старением. Так, снижение основных когнитивных функций (внимание, память, способность к оценке и анализу ситуации, к принятию решений, пространственная ориентация) происходит в возрасте от 40 до 65 лет, хотя у многих людей мозг работает эффективно и после шестидесяти лет. Предполагается, что в основе нарушений когнитивных функций лежат повреждения клеток мозга и изменения метаболических процессов в нем, связанные с гормональной перестройкой. Результаты недавних исследований свидетельствуют, что АЛК противодействует некоторым механизмам таких повреждений. При старении циркуляция крови в мозгу снижается, что приводит к "патологическому метаболическому каскаду", приводящему к различным неврологическим нарушениям и формированию инфаркта мозга. АЛК предохраняет мозг от ишемии благодаря полноценному энергетическому обеспечению организма при меньшем потреблении кислорода тканями [81]. Нейротрофическая и нейропротекторная эффективность АЛК была установлена с помощью широкого спектра методов на различных моделях, в частности показано его модулирующее действие на активность фактора роста нервов [82]. Другое исследование показало, что АЛК также защищает клетки мозга от нейротоксических эффектов аммиака и глутамата [83]. Наличие у АЛК и еще антиоксидантного, и мембраностабилизирующего действия, позволяет рассматривать его как эффективный нейропротектор.В экспериментах на животных бьшо показано, что АЛК не только защищает клетки мозга при ишемии, но и улучшает неврологические последствия болезни. Это изучение указывает на возможность использования АЛК для экстренной интенсивной терапии в отделениях скорой помощи при инсульте и травматических повреждениях в мозгу [84].
Прогрессирующее снижение памяти в пожилом возрасте является чаще всего проявлением болезни Альцгеймера – одного из наиболее распростра ненных нейрогериатрических заболеваний. По статистике это заболевание лежит в основе не менее половины случаев деменции (слабоумия) у пожилых и отмечается у 5-10% лиц старше 65 лет. По оценке специалистов в США от болезни Альцгеймера страдает около 4 миллионов человек, а в России число больных приближается к 1,4 миллиона. Эта болезнь характеризуется отложением амилоидного белка в головном мозгу – как вокруг нейронов с образованием бляшек, так и внутри нейронов с формированием нейрофибриллярных переплетений. Такие изменения имеют патологические последствия для нейрона, которые приводят к потере синапсов и затрагивают нейротрансмиттеры, включая ацетил-холин и, возможно, глутамат, норадреналин и серотонин. Для лечения больных этим заболеванием чаще всего используют ингибиторы холин-эстеразы: такрин, донепезил, ривастигмин, метрифонат и галантамин. Для изучения возможности применения АЛК при болезни Альцгеймера были проведены контролируемые клинические испытания в ряде европейских стран, включая и Россию, которые показали, что он улучшает когнитивные функции как у обычных пожилых людей, так и у пациентов с таким заболеванием.
Хотя результаты использования АЛК для лечения болезни Альцгеймера были противоречивы, однако большинство исследователей отмечают положительный эффект в отношении когнитивных функций, не уступающий эффекту ацетилхолинергических препаратов [85]. Исследование, проведенное в Калифорнии, показало, что АЛК больше помогал больным до 62 лет, чем более старым [86]. В подобном исследовании, проведенном в России, у больных с болезнью Альцгеймера и сосудистой деменцией установлена терапевтическая эффективность и хорошая переносимость препарата. Хотя наибольший эффект от применения препарата отмечается на начальных стадиях болезни и у пациентов до 62 лет, но люди, страдающие от этих заболеваний, но не входящие в эти группы, также могут рассчитывать на другие известные полезные неврологические эффекты АЛК, которые не были оценены в этих испытаниях. Безусловно, длительное применение АЛК может отсрочить, либо замедлить прогрессирование болезни Альцгеймера. Представляет интерес изучить терапевтическую эффективность комбинации антихолинэстеразных препаратов и АЛК при лечении этой болезни.
Учитывая результаты проведенных исследований, интерес к АЛК, как потенциальному геропротектору, значительно увеличился, а его влияние на повышение продолжительности жизни продолжают изучать в широкомасштабных исследованиях. Но уже сейчас в большинстве мировых проектов по оздоровлению населения АЛК используют в качестве многоцелевого средства против старения. Возможно АЛК может быть эффективным при лечении "умеренных когнитивных нарушений" (УКН) или мягких когнитивных расстройств. Этот термин был введен при последнем пересмотре международной классификации болезней (МКБ-10). УКН занимают промежуточное положение между возрастной когнитивной дисфункцией и деменцией. При этом основными патогенетическими механизмами возникновения когнитивных расстройств являются нейродегенеративные процессы и сосудистая мозговая недостаточность[87]. Можно надеяться, что фирмы, производящие АЛК, проведут клинические испытания по определению эффективности этого препарата при УКН.
В последние годы появился ряд сообщений о возможности омолаживания организма с использованием комбинации АЛК с одним или несколькими антиоксидантами, в частности, липоевой кислотой (ЛК), которая образуется в митохондриях, играет в их работе существенную роль и поддерживает постоянный уровень других антиоксидантов. В большой серии исследований, выполненных в последние годы и опубликованных в ведущих американских биологических журналах, было изучено влияние комбинации АЛК и ЛК на восстановление различных биохимических показателей, сниженных в результате окислительного стресса, а также на активность КАТ у старых крыс [88-90]. Было показано, что у старых животных активность этого фермента, а также ее аффинность к АЛК и ацетил-СоА была существенно ниже, чем у молодых крыс. У старых животных после приема АЛК и ЛК значительно улучшился мета болизм, замедлились деструктивные процессы, обусловленные окислительным стрессом, восстановилась активность КАТ и ее аффинность в отношении обоих субстратов. Важно отметить, что некоторые биохимические показатели, которые были изучены в эксперименте, восстанавливались до уровня, наблюдаемого у молодых животных, или отличались от них в незначительной степени. Используя такие показатели когнитивных функций, как пространственная память в водном лабиринте Морриса и тесте временной дискриминации, авторы показали, что кормление старых крыс АЛК и ЛК приводит к восстановлению памяти у старых животных, а, следовательно, улучшается и деятельность мозга. Комбинированное введение АЛК и ЛК старым и вялым крысам (24-28 месяцев) в течение 30 дней делало их более энергичными, их активность соответствовала животным среднего и молодого возраста 7-10 месяцев. Это, как указывают авторы, эквивалентно тому, чтобы сделать из 75-80-летнего старика человека средних лет. Они изучили только краткосрочный эффект, но авторы ожидают получить положительные результаты и в долгосрочном исследовании. Во всех работах указывается, что действие комбинации было эффективнее, чем действие каждого из соединений в отдельности. Однако только надежные клинические исследований могут дать правильную оценку действительной эффективности этих веществ у человека и отсутствия у них каких-либо побочных явлений.
Когнитивные симптомы в пожилом возрасте весьма характерны и для эмоциональных расстройств в виде депрессии, распространенность которой среди пожилых людей достаточно велика. У больных пожилого возраста отмечена высокая сочетаемость депрессии и деменции, хотя симптомы и признаки этих психических расстройств во многом похожи. Решающую роль при лечении депрессии у таких больных в настоящее время играют антидепрессанты. Однако возможность терапевтического воздействия на депрессивные расстройства с помощью антидепрессантов, включая препараты последнего поколения, и других психотропных веществ у пожилых людей существенно ограничены особенностями фармакокинетики и фармакодинамики лекарственных препаратов в старости и повышенной чувствительностью к их побочным действиям. "Идеальный" для позднего возраста препарат должен быть не только безопасным, но и обладать широким спектром действия, учитывая наличие у пожилых людей целого ряда соматических заболеваний. АЛК в значительной степени удовлетворяет этим требованиям. В различных клинических исследованиях была показана высокая эффективность АЛК при широком круге депрессивных расстройств, характерных для пожилого и старческого возраста при отсутствии нежела тельных побочных эффектов, характерных для обычных антидепрессантов [91]. Положительный эффект наблюдался через 4 недели и более после приема препарата, причем у больных среднего возраста он наступал на 2 недели раньше, чем у более старых пациентов [92]. Общим результатом исследований явился вывод о высокой эффективности АЛК, сравнимой с результатами, полученными при лечении другими антидепрессантами, включая, например, флуоксетин [93]. Таким образом, АЛК может быть препаратом выбора для длительного приема у лиц пожилого возраста, у которых симптомы депрессии и деменции (любой этиологии) нередко сочетаются.
В течение многих десятилетий считалось, что нервные клетки (нейроны) в процессе старения только отмирают, но не восстанавливаются. Однако совсем недавно ученые из Принстонского Университета в США установили, что мозговые клетки могут генерировать новые нейроны в мозгу обезьян. Эти новые нейроны образуются глубоко в мозгу около желудочка, затем они поступают в различные области, включая предлобную кору головного мозга, рассматриваемую как область "высших познавательных функций". Значение этого открытия трудно переоценить, поскольку оно доказывает, что нейроны, по крайней мере частично, могут восстанавливаться. Если синтез новых нейронов с таким же успехом возможен и в мозгу человека, следовательно появились дополнительные возможности направленного воздействия на процессы нарушения функции мозга и успешного сохранения познавательных функций до глубокой старости. Новое открытие указывает также на важность снабжения мозга необходимыми биологически активными веществами, которые бы способствовали образованию новых клеток. Было показано, что АЛК является одним из тех веществ, которые могут поддерживать процесс регенерации нервных клеток после их механического повреждения [94]. В эксперименте было установлено, что АЛК проявляет значительный нейрозащитный эффект против дегенерации травмированных моторных нейронов. Эти наблюдения позволили выдвинуть гипотезу относительно возможности восстановления мотонейронов и даже роста нервных клеток, что дает основание считать АЛК важным фактором в комплексе лечебных мероприятий у больных, страдающих от потери нервных функций в результате травмы или нейродегенеративных заболеваний мозга.
Целый ряд клинических и экспериментальных исследований показал, что АЛК эффективен при лечении некоторых нейропатических болевых синдромов, которые являются клиническим проявлением большого числа самостоятельных заболеваний и вызваны поражением или дисфункцией нервной системы.
Тяжелым осложнением сахарного диабета является диабетическая полинейропатия, от которой страдают от 45 до 80% пациентов с этим заболеванием на различных этапах болезни. О целесообразности использования АЛК в лечении этого заболевания имеется много сообщений [66]. Так, в экспериментальных исследованиях диабетической нервной дегенерации и нейропатии бьшо пока зано, что АЛК ускоряет нервную регенерацию после экспериментального повреждения. Бьшо установлено, что "диабетические" крысы, принимавшие АЛК, сохраняли практически нормальную проводимость нервного импульса без какого-либо побочного действия на уровень глюкозы, инсулина и свободных жирных кислот [95]. В другом случае бьшо показано, что карнитиновая недоста точность тесно связана с патогенезом диабетической нейропатии [96]. Эти данные позволяют сделать вывод о том, что АЛК может ускорять регенерацию нервных клеток и препарат на его основе имеет хорошие перспективы для лечения этого типа нейропатии [97].
Противоопухолевые препараты, принадлежащие к платиновым или такса новым группам, являются нейротоксичными агентами, вызывая периферические нейропатии с различными клиническими симптомами. В экспериментальных моделях было показано, что при приеме как цисплатины, так и паклитаксела совместно с АЛК нейротоксичность обоих препаратов заметно снижается. При этом АЛК не оказывает влияния на противоопухолевый эффект препаратов [98].
Нуклеозидные аналоги, являющиеся ингибиторами обратной транскриптазы, нарушают синтез митохондриальной ДНК, ослабляя энергетический метаболизм, и приводят к периферической симметричной полинейропатии (антиретровирусной токсической нейропатии), которая имеет заметную распространенность у ВИЧ-инфицированных пациентов, принимающих эти лекарства. Отмечено, что у таких больных уровень АЛК в плазме заметно снижен. Обнаружено, что карнитин и ацилкарнитины, включая АЛК, при использовании в комбинации с анти-ретровирусными лекарствами не только ингибируют синтез церамида, но также повышают антиретровирусную активность и поддерживают функционирование иммунной системы, нарушенной приемом этих лекарств. Английские исследователи показали, что прием АЛК является патогенетически обоснованной формой лечения периферической нейропатии, вызванной лекарствами от СПИД нуклеозидной природы [99,100].
Полученные результаты свидетельствуют о том, что включение АЛК в лечение больных может оказывать защитное действие от нейропатий, вызванных противоопухолевой или противовирусной терапией.
Показано также, что АЛК защищает клетки мозга от ряда нейротоксических эффектов, вызванных алкогольной интоксикацией [101]. Выявленные в эксперименте положительные метаболические и функциональные эффекты АЛК могут служить хорошей основой для обоснования его клинического применения в терапии алкоголизма [102].
Неферментативное гликозилирование белков в организме млекопитающих, которое происходит в результате прямой реакции восстановленных Сахаров с первичной аминогруппой белков, приводит к образованию поперечносвязанных неприродных молекулярных структур, называемых конечным продуктом гликозилирования (КПГ). Эта реакция играет важную роль в развитии различных патологических изменений, включая и процессы старения животных и человека. Образование КПГ необратимо и эти продукты имеют свойство накапливаться в организме. Продукты гликозилирования белков посредством различных меха низмов индуцируют развитие диабетической нейропатии. Процесс поперечного связывания белков, вызванный гликзилированием, наиболее заметен в коллагене кожи, в мозгу (при старении) и хрусталике глаза. Величина КПГ гликогена кожи может служить надежным параметром при оценке биологического возраста человека или эффективности действия геропротекторов.
Увеличение количества гликозилированного белка в хрусталике глаза приводит к катаракте. Старческая катаракта развивается у некоторых людей в возрасте 50-60 лет. Лечебные препараты, способные полностью избавить человека от этого заболевания, пока не разработаны. Исследователи недавно обнаружили, что с помощью АЛК (но не карнитина) возможно благодаря его антиоксидантным свойствам удается снижать реакции гликозилирования белков хруста лика глаза и замедлять процесс созревания катаракты на 42%. Дополнительные исследования показали, что АЛК вызывает 70%-е снижение количества белков КПГ, образование которых делает катаракту необратимой. Это первое исследование, в котором установлено, что АЛК препятствует процессу "сшива ния" белка в хрусталике глаза, которое дает надежду на создание препарата, предупреждающего развитие катаракты [103]. Поскольку это вещество предотвра щает процессы гликозилования, вероятно, что и при диабетической нейропатии его лечебный эффект в значительной степени связан со снижением КПГ миелиновой оболочки.
Результаты исследований по биохимии и фармакологии L-карнитина и АЛК послужили теоретическим обоснованием для создания лекарственных препаратов на их основе.
Препараты L-карнитина были разрешены в Европе еще в начале 1970 годов в качестве лекарства для лечения сердечных и неврологических заболеваний. В 70-е и в начале 80-х годов, пока не были еще разработаны эффективные процессы получения L-карнитина, на рынке многих стран находился DL-карнитин. В то время отсутствовали достоверные данные о том, что DL-карнитин может проявлять такую же биологическую активность, как L-карнитин. Кроме того, накопились многочисленные факты негативного влиянии DL-карнитина на различные стороны обмена веществ. Это привело к тому, что уже в 1984 году агентство по контролю лекарственных препаратов и пищевых продуктов США приняло решение о недопущении импорта DL-карнитина. Благодаря этому было категорически запрещено использование DL-карнитина в США, и в настоящее время во всем мире используется только L-карнитин. Экспериментальные результаты по сравнительному изучению активности DL-карнитина и L-карнитина, полученные в последние годы [104], только усиливают рекомендации специалистов о недопущении использования рацемического карнитина в медицинской практике. Основным мировым производителем субстанции L-карнитина является швейцарская фирма «Lonza», а лекарственного препарата на его основе (торговое название "Карнитен") – итальянская фирма «Sigma Tau», которая зарегистрировала этот препарат в 30 странах мира, включая США и Россию. Более 50% всех научных публикаций по L-карнитину представлены научными подразделениями этой фирмы.
В СССР DL-карнитин синтезирован во Всесоюзном научно-исследовательском витаминном институте еще в 1968 году, а в 1981 году была разрешена для медицинского применения лекарственная форма препарата на его основе – 20%-й раствор для применения внутрь. В 1993 году был разрешен для медицинского применения 10%-й раствор DL-карнитина в ампулах по 5 мл для внутривенного введения. Оба препарата разработаны в НПО «Витамины» (в настоящее время ФГУП «ГНИИ витаминов»). Однако перспективность применения препаратов L-карнитина и наличие информации о негативном действии его D-изомера, стимулировало исследования по разработке лекарственных средств на основе L-карнитина. В результате проведенной работы в НПО «Витамины» были созданы препараты L-карнитина под торговым названием Элькар и 20%-й раствор Элькара, которые выпускает ООО «ПИК-ФАРМА» (Россия). Они имеются на российском фармацевтическом рынке уже более 3 лет. В ближайшее время эта фирма планирует выпуск 10%-го раствора Элькара для инъекций, а также препарат на основе АЛК под торговым названием «Карницетин». При участии компании «ПИК-ФАРМА» проводится ряд исследований по изучению L-карнитина и АЛК, а также осуществляется выпуск специальной научно-методической литературы, посвященной актуальным проблемам диагностики и лечения ими различных заболеваний.
Таким образом, доклинические, клинические и научные результаты свидетельствуют о целесообразности использования препаратов L-карнитина и АЛК в медицинской практике. Взаимосвязь между экспериментальными данными и клиническим применением L-карнитина и его эфиров в настоящее время продолжает оставаться предметом широкого обсуждения. Полагаем, что настоящий обзор будет стимулировать дальнейшее изучение L-карнитина и других витаминоподобных соединений в странах СНГ.